| País | Documento | Año | Presidente de Chile | Presidente del otro país | Contenido del tratado |
| Chile-Bolivia | Tratado 23º y 25º | 1866 | José Joaquín Pérez | Mariano Melgarejo | Se determina una zona de explotación compartida entre el paralelo 23º y el 25º latitud sur |
| Chile-Bolivia | Tratado 24º | 1874 | Federico Errázuriz | Tomás Frías Ametller | Frontera 24º,mineros chilenos sin impuestos adicionales por estar en territorio boliviano (25 años) |
| EMPIEZA LA GUERRA DEL PACÍFICO | |||||
| Chile-Argentina | Tratado de límites | 1881 | Domingo Santa María | Julio Argentino Roca | La línea fronteriza correría por las cumbres más elevadas de dichas cordilleras que dividirán aguas |
| TERMINA LA GUERRA DEL PACÍFICO | |||||
| Chile-Perú | Tratado de Ancón | 1883 | Domingo Santa María | Miguel Iglesias | Cesión de perpetuidad de la región de Tarapacá a Chile - Cesión temporal de Arica y Tacna |
| Chile-Bolivia | Pacto de Tregua | 1884 | Domingo Santa María | Gregorio Pacheco Leyes | (Después Guerra del Pacífico) Territorios para Chile 23º latitud sur hat desmebocadura del río Loa |
| Chile-Argentina | Protocolo de 1893 | 1893 | Jorge Montt | Luis Sáenz Peña | En la patagonia, Argentina quería las más altas cumbre y Chile la divisoria de aguas. No hubo acuerdo |
| Chile-Argentina | Pacto Primero | 1902 | Germán Riesco Errázuriz | Julio Argentino Roca | Se fijó arbitraje para dirimir las discrepancias entre ambos países |
| Chile-Argentina | Pacto Segundo | 1902 | Germán Riesco Errázuriz | Julio Argentino Roca | Limitación de armamentos y equivalencia naval durante cinco años |
| Chile-Argentina | Arbitraje Rey Eduardo VII | 1902 | Jorge Montt | Julio Argentino Roca | Estableció la línea divisora en el medio del territorio patagónico |
| Chile-Bolivia | Tratado de paz | 1904 | Germán Riesco Errázuriz | Imael Montes Gamboa | Cumplimiento de los territorios cedidos a Chile según el Tratado de paz de 1884 |
| Chile-Argentina | Protocolo Puna de A. | 1888 | Errázuriz Echaurren | Julio Argentino Roca | Se otorgan 20.000 km2 a Chile y 60.000 km2 a Argentina de la Puna de Atacama |
| Chile-Perú | Tratado en Lima | 1929 | Emiliano Figueroa | Pedro José Rada y Garrio | Tacna quedaría para Perú y Arica para Chile (Actual límite chileno-peruano) |
| Chile-Argentina | Arbitraje Reina Isabel II | 1966 | Eduardo Frei Montalva | Arturo Illía | Zona California para los chilenos, valle hondo y norte de río Engaño para Agentina (más grande) |
| Chile-Argentina | Arbitraje Corte Juristas | 1977 | Augusto Pinochet | Jorge Rafael Videla | Dictaminó que el canal Beagle llega hasta el cabo de San Pío. Argentina quedó disconforme |
| Chile-Argentina | Arbitraje Papa Juan Pablo II | 1984 | Augusto Pinochet | Jorge Rafael Videla | El norte y oriente de Beagle para Argentina y el sur y el occidente para Chile |
| Chile-Argentina | Tratado de Paz y Amistad | 1984 | Augusto Pinochet | Jorge Rafael Videla | Anhelo de paz y amistad, solucionar pacíficamente sus problemas, definició de límites |
| Chile-Argentina | Tribunal arbitral | 1994 | Eduardo Frei Ruiz-Tagle | Carlos Menem | 523km2 pertenecen a Argentina de la Laguna del Desierto |
miércoles, 2 de julio de 2008
miércoles, 25 de junio de 2008
Elementos y compuestos químicas, sustancias, etc
Hola!! Bueno, aquí subiendo la materia pa la prueba de quimica que acabo de tener. Sí, el resumen lo hice antes de la prueba jaja Bien, se trata de los elementos y los compuestos y de los modelos atomicos. Despues subire mas, que ten bien, Adios!!
ELEMENTOS QUÍMICOS
Definición:
Los elementos químicos son sustancias puras formadas por una sola clase de átomos. La unidad básica es el átomo y en algunos casos la molécula de elemento
Representación gráfica:
Se representan mediante los símbolos químicos, que constan de una o dos letras. La primera letra siempre será escrita con mayúscula y, si es que hay, la segunda letra siempre será escrita con minúscula. Ej: Na, K, Fe, Cu, etc. El origen de estos símbolos provine de otros idiomas (latín, griego), lugares, o personas importantes.
Clasificación:
Estos elementos químicos están ordenados en la llamada tabla períodica, donde entregan algunos datos mas acerca de estos elementos. En la tabla períodica, las filas (horizontales) son llamadas períodos, los cuales son siete en total y indican la cantidad de niveles atómicos que tienen cada elemento. Las columnas son 18 y los grupos (verticales) son 16, los cuales están agrupados en dos familias: A y B. Los elementos tienen distintos colores: azul, verde, y amarillo indican que son metálicos; rosado y lila indican que son no metálicos y blanco indican que son nuevos y no se saben aún sus características.
Los elementos metálicos tiene propiedades como: tienden a dar electrones, son buenos conductores de electricidad, tienen brillo metálico, tienen un patrón de color gris (Exceptuando el cobre y el oro) y generalmente son sólidos a temperatura ambiente. En cambio, los no metálicos, tiene características como: Tienden a recibir electrones, son malos conductores, con opacos, no tienen un patrón de color, y generalmente son gaseosos a temperatura ambiente.
En la tabla períodica los elementos tienen dos números fundamentales que son número atómico y el número másico. El número atómico (Z) corresponde a la cantidad de protones que tiene el átomo del elemento, y el número másico (A) corresponde a la cantidad de protones y neutrones que tiene el átomo del elemento.
Otro número que no siempre se agrega es el de carga eléctrica. Este número se considera cuando hablamos de un ión. Un ión es átomo que ha perdido o ganado electrones, lo que quiere decir que ya no es eléctricamente neutro. Si gana electrones es llamado anión y queda con carga negativa. Si pierde electrones, se llama catión y queda con carga positiva. Arriba se pone el número de electrones ganados o perdidos y el signo + ó - dependiendo de su carga eléctrica.
Características:
Con estos datos se puede sacar entonces:
- Número de protones: gracias al número atómico
- Número de neutrones: restando el número másico con el número atómico
- Número de electrones: es igual al número de protones a menos de que no sea eléctricamente neutro. Al tener carga negativa, se suman los electrones ganados, y viceversa.
- Número de niveles atómicos: tomando en cuenta los electrones por si es un anión
- Carga eléctrica: dependiendo de si no tiene signo, de si es positivo (+) o negativo (-)
- Característica metálica: dependiendo del color que tiene, si es que es metálico, no metálico o nuevo.
NOTA: la masa de un electrón es aproximadamente, 0.00055 u.m.a, la del protón, 1 u.m.a y la del neutrón también es 1 u.m.a. Por eso, la masa del electrón no es considerada.
Comparación de elementos según su características
Isoelectrónicos: son elementos de igual número de electrones. Esto se da en iones
Isotópicos: son elementos iguales en tipo pero distintos en masa. Esto se debe a la cantidad de neutrones
Isóbaros: son elementos distintos en tipos pero iguales en masa. Esto se debe al número de protones y neutrones
COMPUESTOS QUÍMICOS
Definición:
Los compuestos químicos son sustancias puras formadas por la combinación de dos o más elementos distintos, en proporciones definidas. La unidad básica es la molécula de compuesto.
Representación gráfica:
Se representan gráficamente a través de una fórmula química que consta de letras y números. Las letras son los símbolos de los elementos químicos presentes en el compuesto y los números son llamados subíndices e indican cuántos átomos del elemento hay en una molécula. Ej: H2O señala que están presente el H (hidrógeno) y el O (oxígeno), sólo que en una molécula de H2O hay dos átomos de H. Cuando no se coloca el subíndice se da por entendido que hay sólo un átomo. Otro ejemplo puede ser H2CO3, que es un ácido carbónico compuesto por H, C y O, en las proporciones 2:1:3. Así, en una molécula de ácido carbónico habrán siempre dos átomos de H, 1 de C y 3 de O.
Clasificación:
Se pueden clasificar de distintas maneras: por su naturaleza química, por número de elementos distintos y por función química.
La naturaleza química se refiere a a si son compuestos orgánicos o inorgánicos. Orgánicos se llaman a los compuestos que tienen carbono en el principio de su fórmula química y que, generalmente, también contienen hidrógeno. Por ejemplo: CH4, C6H12O6. Inorgánicos se llama a los que no tienen carbono o lo tienen en medio de la fórmula química. Por ejemplo: H2O, Na2CO3.
Por número de elementos se ha definido una clasificación de compuestos también; si tienen dos elementos, son llamados binarios (Ej: CH4, CO2, H2O, NH3). Si tienen tres elementos, son llamados terciarios (Ej: NaOH, C6H12O6, H2SO4). Por último, si tienen cuatro elementos son nombrados como cuaternarios [Ej: NaHCO3, Mg(OH)Cl]
Por último, tienen otra clasificación que es por función química. Aquí es donde aparecen las llamadas familias, que son clasificaciones según sus propiedades físicas y químicas. Algunas de ellas son:
- Óxidos: Tienen O al final de la fórmula. Se les conocen con el nombre de anhídridos también. Cuando tienen un átomo de O, se les llama monóxidos, cuando tienen dos átomos de O, se les llama dióxidos, cuando tienen tres, trióxidos, y así. Ej: CO2, MgO
- Hídridos: Compuestos con elemento común H. Terminan con las palabras "hídrido". Ej: Ácido Clorhídrico (HCl), Ácido Sulfhídrico (H2S)
- Haluros: son sales que mezclan un elemento metal y un no metal. Siempre va a ser binario. Terminan en "uro". Ej: Cloruro de sodio (NaCl), Cloruro de plata (AgCl), Yoduro de potasio (KI) Tetracloruro de carbono (CCl4)
- Hidróxidos: son los que tienen un elemento metal y el grupo hidroxilo (OH), como por ejemplo, el Hidróxido de sodio (NaOH), el Hidróxido de calcio [Ca(OH)2], Hidróxido de aluminio (Al(OH)3)
- Oxiácidos: son compuestos ternarios, comienzan con H y terminan con O. Por ejemplo: H2SO4 (Ácido sulfúrico), H2CO3 (Ácido carbónico), H3PO4 (Ácido fosfórico)
- Oxisales: son compuestos ternarios, comienzan con un metal, luego con un no metal y termina con O. Tenemos como ejemplos: NaNO3, AgNO3, Al2(SO4)3, CaCO3, NaHCO3
- Alcoholes: son compuestos orgánicos que terminan con el grupo hidroxilo (OH). Ejemplos: CH3OH (Metanol) CH3CH2OH (Etanol)
- Ácidos carboxílicos: son lo que tienen en grupo carboxilo (COOH). En algunas veces en ves de encontrar eso, podremos encontrar CO2H, como en el caso del ácido acético (CH3CO2H)
ESTRUCTURA MOLECULAR
Antecedentes históricos:
Entre el siglo IV y V a.c, en Grecia, Leucipo y Demócrito daban sus referencias acerca de qué era el átomo. Ellos decían que "la materia está formada por diminutas partículas invisibles", las cuales serían del mismo tipo, pero de distintos tamaños y formas. Sin embargo, era algo muy vago y ambiguo.
Tiempo después, en 1661, Robert Boyle dice la primera verdad científica con respecto a los átomos, refiriéndose específicamente a los elementos. Así, también, da lo que se acerca a la primera teoría atómica, sin embargo, está basada en la especulación, por lo que no es totalmente válida. Boyle decía que "Los elementos son indescomponibles químicamente", que "los elementos están constituídos por átomos, las cuales son estructuras indivisibles químicamente"
Sin embargo, en 1805 nace la primera teroría atómica, formulada por Jhon Dalton. Formuló cuatro postulados que dicen:
1) "La materia está formada por átomos pequeños e indivisibles químicamente"
2) "Los átomos de un elemento son iguales en tamaño, peso y propiedades" (No todo tienen igual peso en realidad)
3) "Los átomos de elementos diferentes son distintos en tamaño, peso y propiedades" (Pueden tener igual peso)
4) "Los elementos, cuando reaccionan químicamente, lo hacen siempre en proporciones en peso definidas y constantes"
A pesar de creer que el átomo era la división más pequeña de la naturaleza, en 1897, Joseph Thomson declara que "la materia es de naturaleza eléctrica. Él átomos debe tener partículas con carga negativa y también partículas de carga positiva. Sin embargo, el átomo es neutro eléctricamente". En resumen, Thomson fue el primero en identificar las partículas subatómicas. Por último, hizo el primer modelo atómico, que se basaba en que era "un fluido esférico de carga positiva uniforme en cuyo interior se encuentran los electrones"
Luego, en el año 1911, Ernest Rutherford descartó el modelo de Thomson para dar paso a uno que duró muy poco a pesar de estar ya bastante cerca de la realidad. Este fue el llamado "modelo nuclear o planetario". Lo planteó a base de un experimento que hizo llamado disperción alfa, donde con rayos alfa atravesó una lámina de oro. Como casi ningún rayo se desvió, concluyó que el átomo es prácticamente espacio vacío. Sin embargo, hubo algunos que sí se desviaron. Esto se lo atribuyó a una zona muy pequeña, compacta, de gran masa y con carga positiva llamada núcleo atómico. Este descubrimiento permitió definir los conceptos de número atómico y número másico.
Sin embargo, el tercer modelo atómico y actual es el llamado modelo cuántico propuesto por Niels Bohr en 1927. Más bien, fue una modificación que se hizo al modelo anterior con respecto a los electrones. Éstos ya no girarían desordenadamente en órbitas planetarias, sino en los que llamó "niveles de energía". Cada nivel aceptaría un máximo de electrones y entre más electrones tenga el átomo, más niveles de energía tendrá también. En el nivel 1 acepta tan solo dos electrones, en el nivel 2 acepta ocho, en el nivel 3 acepta diesciocho, en el nivel 4, treinta y dos, y así sucesivamente. Además, este modelo, como dice su nombre, está basado en ecuaciones. Bohr dice que el comportamiento de los electrones puede ser analizado con cuatro números cuánticos: el nivel, el subnivel, la orientación y el giro.
ELEMENTOS QUÍMICOS
Definición:
Los elementos químicos son sustancias puras formadas por una sola clase de átomos. La unidad básica es el átomo y en algunos casos la molécula de elemento
Representación gráfica:
Se representan mediante los símbolos químicos, que constan de una o dos letras. La primera letra siempre será escrita con mayúscula y, si es que hay, la segunda letra siempre será escrita con minúscula. Ej: Na, K, Fe, Cu, etc. El origen de estos símbolos provine de otros idiomas (latín, griego), lugares, o personas importantes.
Clasificación:
Estos elementos químicos están ordenados en la llamada tabla períodica, donde entregan algunos datos mas acerca de estos elementos. En la tabla períodica, las filas (horizontales) son llamadas períodos, los cuales son siete en total y indican la cantidad de niveles atómicos que tienen cada elemento. Las columnas son 18 y los grupos (verticales) son 16, los cuales están agrupados en dos familias: A y B. Los elementos tienen distintos colores: azul, verde, y amarillo indican que son metálicos; rosado y lila indican que son no metálicos y blanco indican que son nuevos y no se saben aún sus características.
Los elementos metálicos tiene propiedades como: tienden a dar electrones, son buenos conductores de electricidad, tienen brillo metálico, tienen un patrón de color gris (Exceptuando el cobre y el oro) y generalmente son sólidos a temperatura ambiente. En cambio, los no metálicos, tiene características como: Tienden a recibir electrones, son malos conductores, con opacos, no tienen un patrón de color, y generalmente son gaseosos a temperatura ambiente.
En la tabla períodica los elementos tienen dos números fundamentales que son número atómico y el número másico. El número atómico (Z) corresponde a la cantidad de protones que tiene el átomo del elemento, y el número másico (A) corresponde a la cantidad de protones y neutrones que tiene el átomo del elemento.
Otro número que no siempre se agrega es el de carga eléctrica. Este número se considera cuando hablamos de un ión. Un ión es átomo que ha perdido o ganado electrones, lo que quiere decir que ya no es eléctricamente neutro. Si gana electrones es llamado anión y queda con carga negativa. Si pierde electrones, se llama catión y queda con carga positiva. Arriba se pone el número de electrones ganados o perdidos y el signo + ó - dependiendo de su carga eléctrica.
Características:
Con estos datos se puede sacar entonces:
- Número de protones: gracias al número atómico
- Número de neutrones: restando el número másico con el número atómico
- Número de electrones: es igual al número de protones a menos de que no sea eléctricamente neutro. Al tener carga negativa, se suman los electrones ganados, y viceversa.
- Número de niveles atómicos: tomando en cuenta los electrones por si es un anión
- Carga eléctrica: dependiendo de si no tiene signo, de si es positivo (+) o negativo (-)
- Característica metálica: dependiendo del color que tiene, si es que es metálico, no metálico o nuevo.
NOTA: la masa de un electrón es aproximadamente, 0.00055 u.m.a, la del protón, 1 u.m.a y la del neutrón también es 1 u.m.a. Por eso, la masa del electrón no es considerada.
Comparación de elementos según su características
Isoelectrónicos: son elementos de igual número de electrones. Esto se da en iones
Isotópicos: son elementos iguales en tipo pero distintos en masa. Esto se debe a la cantidad de neutrones
Isóbaros: son elementos distintos en tipos pero iguales en masa. Esto se debe al número de protones y neutrones
COMPUESTOS QUÍMICOS
Definición:
Los compuestos químicos son sustancias puras formadas por la combinación de dos o más elementos distintos, en proporciones definidas. La unidad básica es la molécula de compuesto.
Representación gráfica:
Se representan gráficamente a través de una fórmula química que consta de letras y números. Las letras son los símbolos de los elementos químicos presentes en el compuesto y los números son llamados subíndices e indican cuántos átomos del elemento hay en una molécula. Ej: H2O señala que están presente el H (hidrógeno) y el O (oxígeno), sólo que en una molécula de H2O hay dos átomos de H. Cuando no se coloca el subíndice se da por entendido que hay sólo un átomo. Otro ejemplo puede ser H2CO3, que es un ácido carbónico compuesto por H, C y O, en las proporciones 2:1:3. Así, en una molécula de ácido carbónico habrán siempre dos átomos de H, 1 de C y 3 de O.
Clasificación:
Se pueden clasificar de distintas maneras: por su naturaleza química, por número de elementos distintos y por función química.
La naturaleza química se refiere a a si son compuestos orgánicos o inorgánicos. Orgánicos se llaman a los compuestos que tienen carbono en el principio de su fórmula química y que, generalmente, también contienen hidrógeno. Por ejemplo: CH4, C6H12O6. Inorgánicos se llama a los que no tienen carbono o lo tienen en medio de la fórmula química. Por ejemplo: H2O, Na2CO3.
Por número de elementos se ha definido una clasificación de compuestos también; si tienen dos elementos, son llamados binarios (Ej: CH4, CO2, H2O, NH3). Si tienen tres elementos, son llamados terciarios (Ej: NaOH, C6H12O6, H2SO4). Por último, si tienen cuatro elementos son nombrados como cuaternarios [Ej: NaHCO3, Mg(OH)Cl]
Por último, tienen otra clasificación que es por función química. Aquí es donde aparecen las llamadas familias, que son clasificaciones según sus propiedades físicas y químicas. Algunas de ellas son:
- Óxidos: Tienen O al final de la fórmula. Se les conocen con el nombre de anhídridos también. Cuando tienen un átomo de O, se les llama monóxidos, cuando tienen dos átomos de O, se les llama dióxidos, cuando tienen tres, trióxidos, y así. Ej: CO2, MgO
- Hídridos: Compuestos con elemento común H. Terminan con las palabras "hídrido". Ej: Ácido Clorhídrico (HCl), Ácido Sulfhídrico (H2S)
- Haluros: son sales que mezclan un elemento metal y un no metal. Siempre va a ser binario. Terminan en "uro". Ej: Cloruro de sodio (NaCl), Cloruro de plata (AgCl), Yoduro de potasio (KI) Tetracloruro de carbono (CCl4)
- Hidróxidos: son los que tienen un elemento metal y el grupo hidroxilo (OH), como por ejemplo, el Hidróxido de sodio (NaOH), el Hidróxido de calcio [Ca(OH)2], Hidróxido de aluminio (Al(OH)3)
- Oxiácidos: son compuestos ternarios, comienzan con H y terminan con O. Por ejemplo: H2SO4 (Ácido sulfúrico), H2CO3 (Ácido carbónico), H3PO4 (Ácido fosfórico)
- Oxisales: son compuestos ternarios, comienzan con un metal, luego con un no metal y termina con O. Tenemos como ejemplos: NaNO3, AgNO3, Al2(SO4)3, CaCO3, NaHCO3
- Alcoholes: son compuestos orgánicos que terminan con el grupo hidroxilo (OH). Ejemplos: CH3OH (Metanol) CH3CH2OH (Etanol)
- Ácidos carboxílicos: son lo que tienen en grupo carboxilo (COOH). En algunas veces en ves de encontrar eso, podremos encontrar CO2H, como en el caso del ácido acético (CH3CO2H)
ESTRUCTURA MOLECULAR
Antecedentes históricos:
Entre el siglo IV y V a.c, en Grecia, Leucipo y Demócrito daban sus referencias acerca de qué era el átomo. Ellos decían que "la materia está formada por diminutas partículas invisibles", las cuales serían del mismo tipo, pero de distintos tamaños y formas. Sin embargo, era algo muy vago y ambiguo.
Tiempo después, en 1661, Robert Boyle dice la primera verdad científica con respecto a los átomos, refiriéndose específicamente a los elementos. Así, también, da lo que se acerca a la primera teoría atómica, sin embargo, está basada en la especulación, por lo que no es totalmente válida. Boyle decía que "Los elementos son indescomponibles químicamente", que "los elementos están constituídos por átomos, las cuales son estructuras indivisibles químicamente"
Sin embargo, en 1805 nace la primera teroría atómica, formulada por Jhon Dalton. Formuló cuatro postulados que dicen:
1) "La materia está formada por átomos pequeños e indivisibles químicamente"
2) "Los átomos de un elemento son iguales en tamaño, peso y propiedades" (No todo tienen igual peso en realidad)
3) "Los átomos de elementos diferentes son distintos en tamaño, peso y propiedades" (Pueden tener igual peso)
4) "Los elementos, cuando reaccionan químicamente, lo hacen siempre en proporciones en peso definidas y constantes"
A pesar de creer que el átomo era la división más pequeña de la naturaleza, en 1897, Joseph Thomson declara que "la materia es de naturaleza eléctrica. Él átomos debe tener partículas con carga negativa y también partículas de carga positiva. Sin embargo, el átomo es neutro eléctricamente". En resumen, Thomson fue el primero en identificar las partículas subatómicas. Por último, hizo el primer modelo atómico, que se basaba en que era "un fluido esférico de carga positiva uniforme en cuyo interior se encuentran los electrones"
Luego, en el año 1911, Ernest Rutherford descartó el modelo de Thomson para dar paso a uno que duró muy poco a pesar de estar ya bastante cerca de la realidad. Este fue el llamado "modelo nuclear o planetario". Lo planteó a base de un experimento que hizo llamado disperción alfa, donde con rayos alfa atravesó una lámina de oro. Como casi ningún rayo se desvió, concluyó que el átomo es prácticamente espacio vacío. Sin embargo, hubo algunos que sí se desviaron. Esto se lo atribuyó a una zona muy pequeña, compacta, de gran masa y con carga positiva llamada núcleo atómico. Este descubrimiento permitió definir los conceptos de número atómico y número másico.
Sin embargo, el tercer modelo atómico y actual es el llamado modelo cuántico propuesto por Niels Bohr en 1927. Más bien, fue una modificación que se hizo al modelo anterior con respecto a los electrones. Éstos ya no girarían desordenadamente en órbitas planetarias, sino en los que llamó "niveles de energía". Cada nivel aceptaría un máximo de electrones y entre más electrones tenga el átomo, más niveles de energía tendrá también. En el nivel 1 acepta tan solo dos electrones, en el nivel 2 acepta ocho, en el nivel 3 acepta diesciocho, en el nivel 4, treinta y dos, y así sucesivamente. Además, este modelo, como dice su nombre, está basado en ecuaciones. Bohr dice que el comportamiento de los electrones puede ser analizado con cuatro números cuánticos: el nivel, el subnivel, la orientación y el giro.
lunes, 23 de junio de 2008
Transporte de sustancias y citoplasma celular - Resumen
Hola!! Yap, este resumen fue sacado exclusivamente del libro del Camilo 1º año medio de biología. En muy fácil la materia, según yo, debería sacarme buena nota. Ahí verán la nota que me saco, creo que hasta ahora mi mejor promedio es biología. Que estén bien, ojalá les sirva, Adios!!
* Transporte de sustancias en la célula
Una de las funciones de la membrana plasmática es el seleccionar las sustancias que entrarán a la célula o que saldrán de ella. El transporte que utiliza esta membrana de permeabilidad selectiva está clasificada en dos tipos: los mecanismos pasivos y los mecanismos activos.
Los mecanismos pasivos son aquellos en que las sustancias se trasladan de un lugar de menor concentración a uno de mayor concentración. No requiere gasto de energía celular (ATP) y se producen por fuerzas ajenas.
Los mecanismos activos son aquellos en que la membrana semipermeable escoge las sustancias que la atravesarán y actúa como una membrana viva, utilizando ATP y llendo en contra de la gradiente de concentración
- Mecanismos Pasivos:
1) Difusión simple: Es un mecanismo de transporte simple y cumple todas sus condiciones. Se basa en la gradiente de concentración de sustancias, es decir, desde las zonas de mayor concentración a las de menor concentración. Por ejemplo, si en el LEC hay un 3% de una sustancia "x" y en el LIC hay un 8% de la misma sustancia, el movimiento de la sustancia será desde el LIC hasta el LEC a través de los poros de la membrana, porque en el LIC hay mayor porcentaje de concentración que en el LEC. La cantidad de moléculas que haya la zona de mayor concentración menos la cantidad de moléculas que haya en la zona de menor concentración, darían lo que llamamos la diferencia de concentración. Cuando la diferencia de concentración es 0, el proceso se detiene.
2) Difusión facilitada: La idea es la misma que la de la difusión simple, solo que es utilizada con las moléculas de mayor tamaño que no pueden ingresar a las célula por los poros de la membrana plasmática. Para ellos utilizan las proteínas llamadas permeasas o carriers, que "ayudan" a las moléculas a ingresar o salir, dependiendo siempre de la gradiente de concentración. Ejemplo de ellos son las moléculas de glucosa, aminoácidos y vitaminas.
3) Osmosis: Se llama al movimiento de H2O según la gradiente de concentración a través de una membrana semipermeable. Si al "lado a" de la membrana hay un 30% de agua y un 70% de sales y en el "lado b" hay un 60% de agua y un 40% de sales, el agua se trasladará desde el "lado b" al "lado a". Sin embargo, pocas veces ocurre esto en una célula. Generalmente, la diferencia de concentración de agua del LIC y el LEC es la misma o muy similar. A las sustancias que tienen igual concentración de agua que una célula son llamadas Isotónicas, como la sangre, el suero fisológico, la savia en las plantas, la linfa y otra soluciones. En cambio, las sustancias de mayor o menor concentración de agua que las células son llamadas Hipotónicas y Hipertónicas respectivamente, las cuales tienen concecuencias como la Citólisis (Autodestrucción de una célula), ya sea por deshidratación (Crenación en los animales, Plasmólisis en los vegetales) o por una explosión celular a raíz de un exceso de agua.
4) Diálisis: Es un proceso que se realiza a través de una membrana semipermeable donde se separan las moléculas más pequeñas de las macromoléculas. Un ejemplo de ello es en los riñones, donde la diálisis cumple una función fundamenta con la orina.
- Mecanismos Activos:
1) Transporte Activo: Es un mecanismo que gasta ATP que consta del paso de moléculas al interior de la célula a través de las permeasas o carriers. A diferencia de la difusión facilitada, la membrana capta esta molécula y la absorve al LIC, llendo en contra de la gradiente de concentración. Por ejemplo, si dentro de la célula hay 8 moléculas de glucosa y fuera llegan dos más, la membrana las captará para introducirlas con las demás, desde las zonas de menor concentración a las mayor concentración.
2) Endocitosis: Proceso en el cual se ingresan moléculas de tamaño considerable al citoplasma celular a través de la formación de vacuolas. Exiten dos tipos de endocitosis: la fagocitosis y la pinocitosis.
 Fagocitosis: experimenta una evaginación en la membrana celular, envolviendo las moléculas y formando una vacuola fagocítica.
Fagocitosis: experimenta una evaginación en la membrana celular, envolviendo las moléculas y formando una vacuola fagocítica.
 Pinocitosis: experimenta una invaginación; la membrana celular forma un agujero en donde se meten las moléculas y luego las encierra, formando una vacuola pinocítica.
Pinocitosis: experimenta una invaginación; la membrana celular forma un agujero en donde se meten las moléculas y luego las encierra, formando una vacuola pinocítica.
3) Exocitosis: Proceso en el cual se expulsan sustancias (desechos). Primero, se forma un vacuola para encerrar la sustancia a eliminar, la cual es llevada al aparato de Golgi. Allí es enviada a la membrana plasmática, fusionándose con ella para, posteriormente, realizar la eliminación de la sustancia. Es el proceso contrario a la endocitosis.
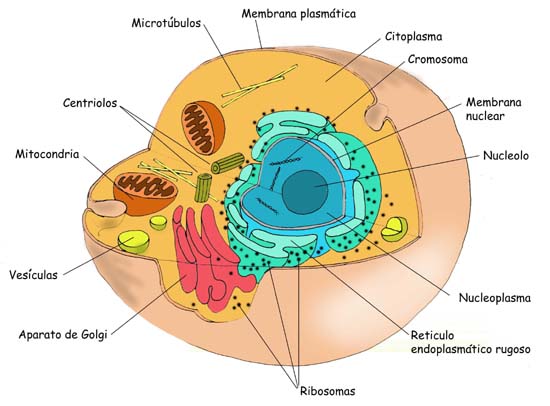
Si bien hemos visto cómo las moléculas entran o salen de la célula, no hemos hablado de lo que hay dentro de ella y qué ocurre con las sustancias que entran y salen. Bien, desde la membrana plasmática hasta el núcleo de la célula es llamado citoplasma celular. Es de aspecto gelatinoso o coloidal, en la cual se hayan suspendido varios organelos u organoides, los cuales tienen diferentes funciones dentro de la célula. Exiten el retículo endoplasmático, los ribosomas, el aparato de Golgi, los lisosomas, las mitocondrias, los cloroplastos (sólo en vegetales), los centriolos, las vacuolas, y los flagelos.
A) Retículo Endoplasmático: Es una red de pequeños canales con membranas muy delgada cuya función principal es transportar sustancias. Sin embargo, en toda célula es posible distinguir dos tipos de retículos endoplasmáticos: el liso y el rugoso. El Retículo Endoplasmático Liso (REL) tiene aspecto liso, como lo indica el nombre, y su función es transportar especialmente lípidos. En cambio, el Retículo Endoplasmático Rugoso (REG) tiene un aspecto poroso a causa de los ribosomas que tiene adheridos a sus membranas. Su principal función es la de transportar especialmente proteínas.
B) Ribosomas: Son organelos compuestos por ARN y proteínas encargados del proceso metabólico de la célula. Se encuentra en variados modos: aislados, en grupo formando polirribosomas o adheridos al REG, dentro de las mitocondrias y los cloroplastos. Están divididos en una parte mayor y una menor. Todas ejecutan las órdenes del ADN.
C) Complejo o Aparato de Golgi: es un compartimiento membranoso que se encuentra en las células animales y vegetales, sólo que en las vegetales se le llama dictiosoma. Se le encuentra muy parecido al REG, a diferencia de que sus extremos son dilatados. Sus principales funciones son el empaquetamiento temporal de una sustancia para su posterior eliminación, la formación de vacuolas para la eliminación de sustancias y la formación de los lisosomas.
D) Lisosomas: son bolsitas o vesículas llenas de enzimas digestivas capaces de digerir las grandes moléculas de lípids, carbohidratos, ácidos nucléicos y proteínas que entran por medio de la endocitosis. Están encargadas de la digestión intracelular, ya sea de sustancias exógenas (provenientes del exterior) o endógenas (provenientes del interior). Esto último ocurre cuando algún organelo no está funcionando bien y se produce su muerte denominada autofagia. Las membranas de los lisosomas son estables, pero si se dañan, el contenido enzimático puede llegar a provocar lo que se llama autodiálisis, es decir, un suicidio celular.
E) Mitocondrias: son los organelos más complejos que existen en la célula, junto con los cloroplastos. Son casi autónomos, ya que poseen un propio ADN, ribosomas, enzimas, y pueden rerpoducirse por su propia cuenta. Cuenta con dos membranas, una interior de mayor longitud que se pliega en el interior formando lo que llamamos crestas mitocondriales y una exterior que la cubre completamente. La función más importante de las mitocondrias es el proporcionar energía a la célula, siendo centrales energéticas que toda célula necesita para desarrollar sus complejos procesos metabólicos. Es en estos organelos que se produce la respiración celular, que consta de la oxidación de componentes como la glucosa y la extracción de energía, transformada posteriormente en ATP. La fórmula es: C6H12O6 + O2 -> CO2 + H2O + Energía.
F) Cloroplastos: están presentes en todas las células vegetales, ya que son los encargados de la fotosíntesis. Dentro de sus dos membranas, se encuentra un espacio conocido como Estroma, donde se encuentra una serie de estructuras membranosas con forma de pilas de monedas llamadas granas, que se comunican a través de las laminillas intergranas. Cada "moneda" de la grana es llamada tilakoide, que contienen la clorofila (pigmento fotosintético verde). Al igual que la mitocondria, son casi autónomos, ya que tienen sus propios ribosomas, su propio ADN, contienen enzimas y son capaces de duplicarse igualmente. El proceso fotosintético tiene su propia expresión también: 6CO2 + 6H2O + ATP -> C6H12C6 + 6O2
G) Vacuolas: Organelos presentes en todas las células. En la célula animal, son varias y pequeñas, y su función principal es almacenar sustancias no vivas. En cambio, en las células vegetales, las vacuolas se fucionan para formar una sola gran vacuola que ocupa gran parte del citoplasma y tiene como función almacenar agua y solutos que permiten la turgencia interna a cada célula vegetal.
H) Centriolos: también llamados Centrosomas, están presentes en todas las células animales menos en las neuronas y ausentes en las células vegetales. Son dos cilindros que cumplen la función de formar fibras llamadas Fibras de Huso para la reproducción de dos células hijas idénticas a las células madres. También ayudan a la formación de cilios y flagelos
I) Cilios y flagelos: Son organelos presentes sólo en las células animales y son extensiones del citplasma celular que cumplen la función de locomoción y de aumentar la superficie de contacto celular

* Transporte de sustancias en la célula
Una de las funciones de la membrana plasmática es el seleccionar las sustancias que entrarán a la célula o que saldrán de ella. El transporte que utiliza esta membrana de permeabilidad selectiva está clasificada en dos tipos: los mecanismos pasivos y los mecanismos activos.
Los mecanismos pasivos son aquellos en que las sustancias se trasladan de un lugar de menor concentración a uno de mayor concentración. No requiere gasto de energía celular (ATP) y se producen por fuerzas ajenas.
Los mecanismos activos son aquellos en que la membrana semipermeable escoge las sustancias que la atravesarán y actúa como una membrana viva, utilizando ATP y llendo en contra de la gradiente de concentración
- Mecanismos Pasivos:
1) Difusión simple: Es un mecanismo de transporte simple y cumple todas sus condiciones. Se basa en la gradiente de concentración de sustancias, es decir, desde las zonas de mayor concentración a las de menor concentración. Por ejemplo, si en el LEC hay un 3% de una sustancia "x" y en el LIC hay un 8% de la misma sustancia, el movimiento de la sustancia será desde el LIC hasta el LEC a través de los poros de la membrana, porque en el LIC hay mayor porcentaje de concentración que en el LEC. La cantidad de moléculas que haya la zona de mayor concentración menos la cantidad de moléculas que haya en la zona de menor concentración, darían lo que llamamos la diferencia de concentración. Cuando la diferencia de concentración es 0, el proceso se detiene.
2) Difusión facilitada: La idea es la misma que la de la difusión simple, solo que es utilizada con las moléculas de mayor tamaño que no pueden ingresar a las célula por los poros de la membrana plasmática. Para ellos utilizan las proteínas llamadas permeasas o carriers, que "ayudan" a las moléculas a ingresar o salir, dependiendo siempre de la gradiente de concentración. Ejemplo de ellos son las moléculas de glucosa, aminoácidos y vitaminas.
3) Osmosis: Se llama al movimiento de H2O según la gradiente de concentración a través de una membrana semipermeable. Si al "lado a" de la membrana hay un 30% de agua y un 70% de sales y en el "lado b" hay un 60% de agua y un 40% de sales, el agua se trasladará desde el "lado b" al "lado a". Sin embargo, pocas veces ocurre esto en una célula. Generalmente, la diferencia de concentración de agua del LIC y el LEC es la misma o muy similar. A las sustancias que tienen igual concentración de agua que una célula son llamadas Isotónicas, como la sangre, el suero fisológico, la savia en las plantas, la linfa y otra soluciones. En cambio, las sustancias de mayor o menor concentración de agua que las células son llamadas Hipotónicas y Hipertónicas respectivamente, las cuales tienen concecuencias como la Citólisis (Autodestrucción de una célula), ya sea por deshidratación (Crenación en los animales, Plasmólisis en los vegetales) o por una explosión celular a raíz de un exceso de agua.
4) Diálisis: Es un proceso que se realiza a través de una membrana semipermeable donde se separan las moléculas más pequeñas de las macromoléculas. Un ejemplo de ello es en los riñones, donde la diálisis cumple una función fundamenta con la orina.
- Mecanismos Activos:
1) Transporte Activo: Es un mecanismo que gasta ATP que consta del paso de moléculas al interior de la célula a través de las permeasas o carriers. A diferencia de la difusión facilitada, la membrana capta esta molécula y la absorve al LIC, llendo en contra de la gradiente de concentración. Por ejemplo, si dentro de la célula hay 8 moléculas de glucosa y fuera llegan dos más, la membrana las captará para introducirlas con las demás, desde las zonas de menor concentración a las mayor concentración.
2) Endocitosis: Proceso en el cual se ingresan moléculas de tamaño considerable al citoplasma celular a través de la formación de vacuolas. Exiten dos tipos de endocitosis: la fagocitosis y la pinocitosis.
 Fagocitosis: experimenta una evaginación en la membrana celular, envolviendo las moléculas y formando una vacuola fagocítica.
Fagocitosis: experimenta una evaginación en la membrana celular, envolviendo las moléculas y formando una vacuola fagocítica. Pinocitosis: experimenta una invaginación; la membrana celular forma un agujero en donde se meten las moléculas y luego las encierra, formando una vacuola pinocítica.
Pinocitosis: experimenta una invaginación; la membrana celular forma un agujero en donde se meten las moléculas y luego las encierra, formando una vacuola pinocítica.3) Exocitosis: Proceso en el cual se expulsan sustancias (desechos). Primero, se forma un vacuola para encerrar la sustancia a eliminar, la cual es llevada al aparato de Golgi. Allí es enviada a la membrana plasmática, fusionándose con ella para, posteriormente, realizar la eliminación de la sustancia. Es el proceso contrario a la endocitosis.
Si bien hemos visto cómo las moléculas entran o salen de la célula, no hemos hablado de lo que hay dentro de ella y qué ocurre con las sustancias que entran y salen. Bien, desde la membrana plasmática hasta el núcleo de la célula es llamado citoplasma celular. Es de aspecto gelatinoso o coloidal, en la cual se hayan suspendido varios organelos u organoides, los cuales tienen diferentes funciones dentro de la célula. Exiten el retículo endoplasmático, los ribosomas, el aparato de Golgi, los lisosomas, las mitocondrias, los cloroplastos (sólo en vegetales), los centriolos, las vacuolas, y los flagelos.
A) Retículo Endoplasmático: Es una red de pequeños canales con membranas muy delgada cuya función principal es transportar sustancias. Sin embargo, en toda célula es posible distinguir dos tipos de retículos endoplasmáticos: el liso y el rugoso. El Retículo Endoplasmático Liso (REL) tiene aspecto liso, como lo indica el nombre, y su función es transportar especialmente lípidos. En cambio, el Retículo Endoplasmático Rugoso (REG) tiene un aspecto poroso a causa de los ribosomas que tiene adheridos a sus membranas. Su principal función es la de transportar especialmente proteínas.
B) Ribosomas: Son organelos compuestos por ARN y proteínas encargados del proceso metabólico de la célula. Se encuentra en variados modos: aislados, en grupo formando polirribosomas o adheridos al REG, dentro de las mitocondrias y los cloroplastos. Están divididos en una parte mayor y una menor. Todas ejecutan las órdenes del ADN.
C) Complejo o Aparato de Golgi: es un compartimiento membranoso que se encuentra en las células animales y vegetales, sólo que en las vegetales se le llama dictiosoma. Se le encuentra muy parecido al REG, a diferencia de que sus extremos son dilatados. Sus principales funciones son el empaquetamiento temporal de una sustancia para su posterior eliminación, la formación de vacuolas para la eliminación de sustancias y la formación de los lisosomas.
D) Lisosomas: son bolsitas o vesículas llenas de enzimas digestivas capaces de digerir las grandes moléculas de lípids, carbohidratos, ácidos nucléicos y proteínas que entran por medio de la endocitosis. Están encargadas de la digestión intracelular, ya sea de sustancias exógenas (provenientes del exterior) o endógenas (provenientes del interior). Esto último ocurre cuando algún organelo no está funcionando bien y se produce su muerte denominada autofagia. Las membranas de los lisosomas son estables, pero si se dañan, el contenido enzimático puede llegar a provocar lo que se llama autodiálisis, es decir, un suicidio celular.
E) Mitocondrias: son los organelos más complejos que existen en la célula, junto con los cloroplastos. Son casi autónomos, ya que poseen un propio ADN, ribosomas, enzimas, y pueden rerpoducirse por su propia cuenta. Cuenta con dos membranas, una interior de mayor longitud que se pliega en el interior formando lo que llamamos crestas mitocondriales y una exterior que la cubre completamente. La función más importante de las mitocondrias es el proporcionar energía a la célula, siendo centrales energéticas que toda célula necesita para desarrollar sus complejos procesos metabólicos. Es en estos organelos que se produce la respiración celular, que consta de la oxidación de componentes como la glucosa y la extracción de energía, transformada posteriormente en ATP. La fórmula es: C6H12O6 + O2 -> CO2 + H2O + Energía.
F) Cloroplastos: están presentes en todas las células vegetales, ya que son los encargados de la fotosíntesis. Dentro de sus dos membranas, se encuentra un espacio conocido como Estroma, donde se encuentra una serie de estructuras membranosas con forma de pilas de monedas llamadas granas, que se comunican a través de las laminillas intergranas. Cada "moneda" de la grana es llamada tilakoide, que contienen la clorofila (pigmento fotosintético verde). Al igual que la mitocondria, son casi autónomos, ya que tienen sus propios ribosomas, su propio ADN, contienen enzimas y son capaces de duplicarse igualmente. El proceso fotosintético tiene su propia expresión también: 6CO2 + 6H2O + ATP -> C6H12C6 + 6O2
G) Vacuolas: Organelos presentes en todas las células. En la célula animal, son varias y pequeñas, y su función principal es almacenar sustancias no vivas. En cambio, en las células vegetales, las vacuolas se fucionan para formar una sola gran vacuola que ocupa gran parte del citoplasma y tiene como función almacenar agua y solutos que permiten la turgencia interna a cada célula vegetal.
H) Centriolos: también llamados Centrosomas, están presentes en todas las células animales menos en las neuronas y ausentes en las células vegetales. Son dos cilindros que cumplen la función de formar fibras llamadas Fibras de Huso para la reproducción de dos células hijas idénticas a las células madres. También ayudan a la formación de cilios y flagelos
I) Cilios y flagelos: Son organelos presentes sólo en las células animales y son extensiones del citplasma celular que cumplen la función de locomoción y de aumentar la superficie de contacto celular


martes, 17 de junio de 2008
La luz - Cuestionario
Hola! Este es un cuestionario que hice el día antes de la prueba leyendo la materia que me pasó Otarola y haciéndome una pregunta de cada cosa. Tal vez después ponga algunos ejercicios porque no hay de aplicación. También trataré de agregarle imágenes. Es todo, Adios!!
Segundo rayo: Todo rayo que incide pasando por el foco (primer foco) se refracta paralelo al eje principal
Tercer rayo: Todo rayo que pasa por el centro de la lente se refracta en la misma dirección y sentido
Lente bicóncava:
Primer rayo: Todo rayo que incide paralelo al eje principal se refracta de manera que su prolongación pase por el foco (primer foco)
Segundo rayo: Todo rayo incidente cuya prolongación pase por el foco (segundo foco) se refracta paralelo al eje principal
Tercer rayo: Todo rayo incidente que pasa por el centro se refracta en la misma dirección y sentido
La Luz
- ¿A qué se refiere la frase “La luz tiene un comportamiento dual”?
- ¿Cuáles son las características de la luz como onda?
- ¿Quién formuló la teoría corpuscular y quién la finalizó?
- ¿En que se basa la teoría corpuscular?
- ¿Qué son las cosas que en un principio no podían comprobar?
- ¿Cómo algunos cuerpos emitían la luz?
- Explica ahora las cosas con las que no se podía comprobar esta teoría
- ¿Quién formuló la teoría ondulatoria y quién la finalizó?
- ¿En qué basa la teoría ondulatoria?
- ¿Qué son las cosas que en un principio no podían comprobar?
- ¿A qué corresponde el “índice de refracción”?
- ¿Qué permite calcular “n”?
- ¿Qué es lo principal que nos permite la reflexión de la luz?
- ¿Cómo se llama la reflexión que nos permite ver forma, color y textura? Explícala
- ¿Qué es la reflexión interna total?
- ¿Cuándo se produce el ángulo crítico de incidencia?
- Describe alguna aplicación de esta propiedad y explícala
- ¿Qué es un espejo?
- ¿Qué tipos de imagen se pueden ver en un espejo plano?
- ¿Cuántos tipos de espejos curvos existen?
- ¿Por qué se les llama espejos convergentes y divergentes?
- Explica cuáles son los tres rayos principales de un espejo convergente
- ¿Qué tipos de imagen se pueden ver en un espejo curvo?
- ¿Qué características puede tener una imagen?
- Explica cuáles son los tres rayos principales de un espejo cóncavo
- ¿Qué es “f”? ¿Cuándo se considera positivo y cuándo negativo?
- ¿Qué es “do”? ¿Cuándo se considera positivo y cuándo negativo?
- ¿Qué es “di”? ¿Cuándo se considera positivo y cuándo negativo?
- ¿Qué es “M”? ¿Cuándo se considera positivo y cuándo negativo?
- ¿Qué es una lente? ¿En qué se diferencia básicamente de un espejo?
- ¿Cuántas lentes existen?
- Explica cuáles son los tres rayos principales de cada tipo de lente
SOLUCIONES:
- Se dice que la luz tiene un comportamiento dual porque tiene comportamiento de partícula y de onda a la vez
- Como onda, la luz es electromagnética, transversal y viajera
- La teoría corpuscular la formuló Isaac Newton y la finalizó Albert Einstein
- La teoría corpuscular se basa en que la luz se propaga en rectilínea, en que cuando se interpone un obstáculo se produce sombra y en que cuando los corpúsculos rebotan sobre una superficie se produce reflexión
- No se podía comprobar por qué los cuerpos no pierden masa al emitir corpúsculos y por qué algunos corpúsculos se reflejan y otros se refractan
- Algunos cuerpos emitían luz cuando un electrón se cambiaba a un nivel de energía más lejano al núcleo. Ganaba energía y luego se cambiaba a su nivel original, liberando la energía acumulada. Esa energía es llamada fotón y es una partícula de luz.
- Los cuerpos no pierden masa al emitir luz porque solo pierden la energía que ganaron los electrones al cambiarse de nivel (atómicamente hablando) y los corpúsculos se reflejan o refractan dependiendo del medio con el que se haya encontrado. Por ejemplo, en un espejo va a reflejarse. En cambio, en un lente, va a refractarse.
- La teoría ondulatoria la formuló Christian Hudgens y la finalizó Thomas Young
- La teoría corpuscular se basa en que los cuerpos, al emitir luz, no pierden masa, que su propagación es rectilínea y la reflexión de la luz de explican suponiendo que la luz es una onda y que la luz experimenta refracción
- En un principio no se podía comprobar la interferencia y la difracción de la luz, pero con el experimento fotoeléctrico o de la sobre rendija, se pudieron comprobar estas propiedades de la luz como onda
- Corresponde a la razón entre la velocidad de propagación de la luz en el vacío ( C ) y la velocidad de propagación en el medio en cuestión (Vm). Es decir, C/Vm. El Índice de refracción del vacío es 1 y el de todos los demás medios es mayor a 1
- El Índice de refracción permite calcular el ángulo de refracción al ingresar a un nuevo medio a través de una fórmula matemática. Al igual, se puede saber el ángulo de la reflexión interna total
- La reflexión de la luz nos permite ver todas las cosas que hay a nuestro alrededor: su forma, su color, su textura, etc.
- La reflexión que nos permite percibir la forma, el color y la textura de un cuerpo es la reflexión difusa, y es cuando la superficie al que llegan los rayos incidentes no es plana. Por el contrario, la reflexión especular es cuando la superficie a la que llegan los rayos incidentes es totalmente lisa y plana.
- La reflexión interna total se produce cuando el ángulo de reflexión es mayor al ángulo crítico de incidencia
- El ángulo crítico de incidencia de produce cuando el rayo refractado coincide con la interfase (la superficie del segundo medio)
- La mejor aplicación es la fibra óptica: es un tubo por donde pasa la luz reflejándose en cada uno de los lados del tubo. Sirve para examinar motores o el interior del cuerpo humano. También se utiliza para los medios de comunicación
- Un espejo es una superficie lisa y muy bien pulimentada. Por lo general son de vidrio con una delgada placa de pintura metálica o una superficie metálica bien pulida
- En un espejo plano sólo se ven imágenes virtuales
- Existen dos tipos de espejos curvos: los espejos cóncavos o convergentes y convexos o divergentes (NOTA: Todos los espejos curvos tienen un foco, un centro, y un vértice. Los espejos cóncavos tienen el foco y el centro a su izquierda, y los espejos convexos a su derecha)
- Se llaman espejos convergentes y divergentes, porque en el primer caso, los haces de luz se juntan en algún punto (que es el punto donde resulta estar la imagen). En el caso contrario, los rayos divergen o van en direcciones contrarias, no juntándose nunca. En ese caso, se trabaja con la prolongaciones de los rayos
- Primer rayo: Todo rayo que incide paralelo al eje principal, se refleja pasando por el foco
Segundo rayo: Todo rayo que incide pasando por el foro, se refleja paralelo al eje principal
Tercer rayo: Todo rayo que incide pasando por el centro se refleja en la misma dirección pero en sentido contrario
- En un espejo curvo se pueden ver dos tipos de imágenes: reales y virtuales. La imagen es real si se forma con los rayos reflejados. La imagen se denomina virtual si se forma con la prolongación de los rayos reflejados (NOTA: Las imágenes reales solo se pueden ver si se recogen en una pantalla)
- La imagen tiene tres características: tipo de imagen (real o virtual), tamaño (Más pequeña, más grande o igual al objeto) y la posición (derecha con respecto al objeto o invertido con respecto al objeto)
- Primer rayo: Todo rayo que incide paralelo al eje principal se refleja de manera que su prolongación pase por el foco
Segundo rayo: Todo rayo incidente cuya prolongación pasa por el foco, se refleja paralelo al eje principal
Tercer rayo: Todo rayo incidente cuya prolongación pasa por el centro se refleja en la misma dirección pero en sentido contrario
- “f” es la distancia focal, es decir, la distancia que hay desde el foco hasta el vértice. Se considera positivo cuando el espejo es cóncavo y negativo cuando es convexo
- “do” es la distancia objeto, es decir, la distancia que hay entre el objeto y el vértice. Siempre se considera positivo
- “di” es la distancia imagen, es decir, la distancia que hay entre la imagen y el vértice. Se considera positivo cuando la imagen es real y negativo cuando es virtual
- “M” es la Magnificación, es decir, la razón entre la distancia de la imagen y la distancia del objeto. Siempre se anota antes de la razón el signo negativo (-di/do)
- Una lente óptica está formada por un material transparente y una o ambas superficies tiene un contorno esférico. Se diferencia del espejo en que tiene dos superficies y en que los rayos de luz, en vez de reflejarse, se refractan. (NOTA: Las lentes tienen dos focos y dos centros, pero un solo vértice)
- Existen dos tipos de lentes: lentes bicóncavos o divergentes y lentes biconvexos o convergentes. (NOTA: Nótese que ahora se han intercambiado las denominaciones de convergente y divergente)
- Lente biconvexa:
Segundo rayo: Todo rayo que incide pasando por el foco (primer foco) se refracta paralelo al eje principal
Tercer rayo: Todo rayo que pasa por el centro de la lente se refracta en la misma dirección y sentido
Lente bicóncava:
Primer rayo: Todo rayo que incide paralelo al eje principal se refracta de manera que su prolongación pase por el foco (primer foco)
Segundo rayo: Todo rayo incidente cuya prolongación pase por el foco (segundo foco) se refracta paralelo al eje principal
Tercer rayo: Todo rayo incidente que pasa por el centro se refracta en la misma dirección y sentido
Suscribirse a:
Entradas (Atom)